Introduction
La disponibilité de produits biologiques pour la rrinosinusite chronique sévère et non contrôlée avec polypes nasaux (RCCP) a révolutionné le paysage thérapeutique des patients souffrant de polypes nasaux, les produits biologiques étant inclus dans les dernières directives internationales pour les patients souffrant de RCCP (1-4). L'omalizumab, le mépolizumab et le dupilumab sont enregistrés et remboursés pour l'indication des polypes nasaux sévères non contrôlés dans plusieurs pays du monde (5,6). L'efficacité et la sécurité de ces produits biologiques ont été démontrées dans de vastes essais randomisés de phase III en double aveugle contre placebo (DBRCT) et plusieurs études de comparaison indirecte ont tenté de comparer l'efficacité de ces différents produits biologiques (7-13).
Cependant, en raison de l'hétérogénéité des critères d'inclusion et des résultats des traitements dans les différents essais, une véritable comparaison est impossible, ce qui souligne la nécessité de réaliser des essais comparatifs directs et des registres d'efficacité dans le monde réel (RWE). À ce jour, les registres d'efficacité en situation réelle ont principalement étudié le dupilumab en Italie (14), aux Pays-Bas (15), au Canada (16) et en Allemagne (17). On ne dispose que de données limitées, essentiellement rétrospectives, sur le mépolizumab et l'omalizumab (18,19). Comme ces deux produits biologiques ont été les premiers à être approuvés et remboursés en Belgique (20), une étude multicentrique sur l'EFR a été lancée dans huit centres de rhinologie en Belgique. L'étude s'est concentrée sur l'EFR des deux produits biologiques dans la première vague de patients atteints de CRSwNP non contrôlé, traités pendant six mois par une thérapie biologique pour le CRSwNP non contrôlé, et qui répondaient aux critères de remboursement nationaux. Outre l'étude de l'efficacité de ces produits biologiques, cette étude s'intéresse également à l'impact des thérapies biologiques sur la définition récemment mise à jour par EUFOREA/EPOS du contrôle du CRSwNP, défini comme l'absence de symptômes sinonasaux cliniquement pertinents d'une maladie active (21). Comme on pense que les produits biologiques pourraient avoir un potentiel de modification de la maladie (22), la compréhension de leur effet sur le contrôle à long terme de la maladie sans signes de maladie active, également défini comme une rémission (21), est d'une importance stratégique tant pour les patients que pour les médecins.
Matériels et méthodes
Population de patients
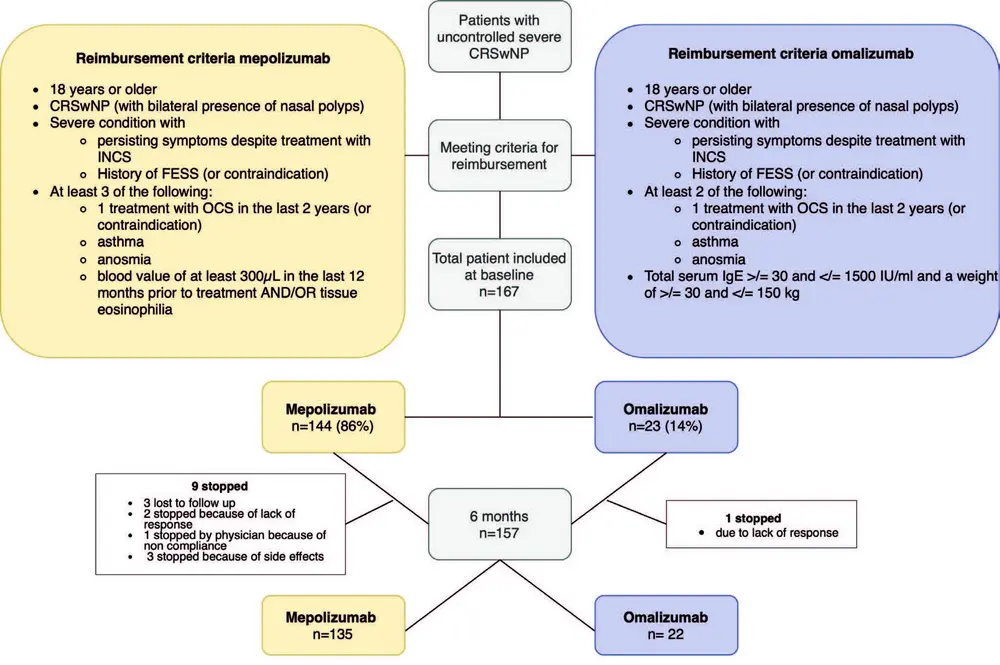
Cette étude RWE a été coordonnée par A.S.V. et P.H. à l'UZ Leuven, Belgique, et a été réalisée dans 8 centres nationaux, 5 hôpitaux universitaires (Louvain, Anvers, Bruxelles, Liège et Saint-Luc) et 3 centres de rhinologie non universitaires (Alost, Genk et Bruges). L'étude a été évaluée et approuvée par le comité d'éthique médicale de l'hôpital universitaire de Louvain (S66646). Les patients qui remplissaient les critères cliniques et de remboursement (Figure 1) pour le mépolizumab ou l'omalizumab ont été inclus dans l'étude et ont fait l'objet d'un suivi prospectif. Les patients étaient exclus s'ils avaient reçu un autre traitement biologique pour le CRSwNP dans les 3 mois précédant le début de l'étude.
Caractéristiques de base
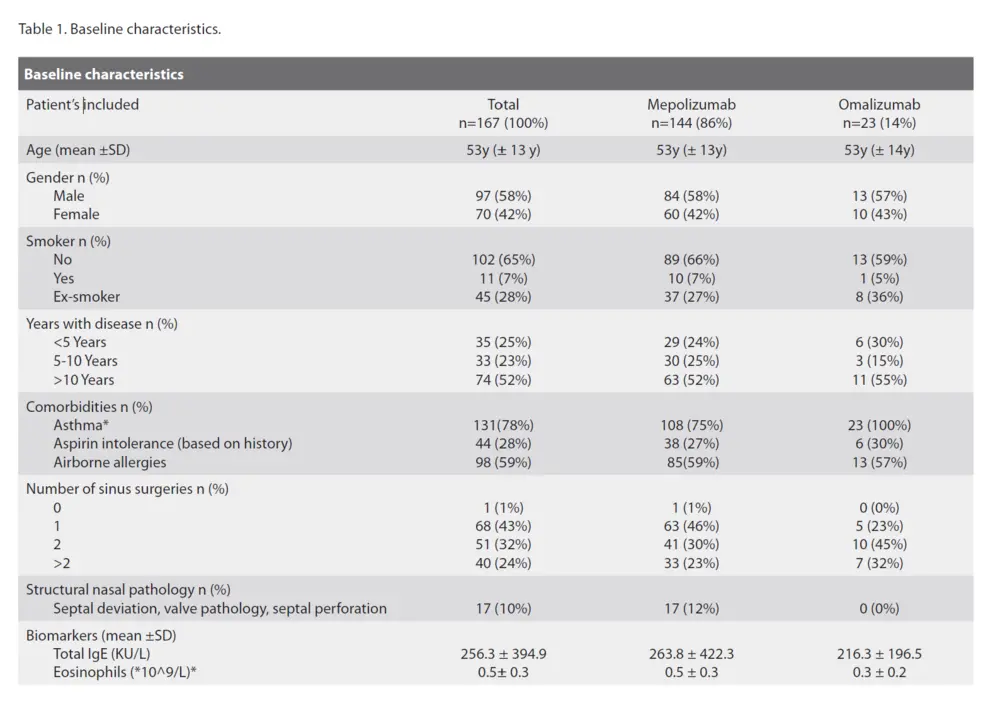
Les caractéristiques générales des patients, notamment l'âge, le sexe, l'année du diagnostic de CRSwNP, les comorbidités et l'état de santé général, ont été recueillies. Les patients ont été interrogés sur leurs comorbidités, qui ont été vérifiées à l'aide des antécédents médicaux des patients dans leur dossier médical.
Évaluation des résultats rapportés par les patients (PRO)
Des questionnaires ont été remplis au début du traitement et après 4, 12 et 24 semaines de traitement. Les questionnaires comprenaient des questions sur les voies aériennes supérieures (score de congestion nasale (NCS), score sur l'échelle visuelle analogique (VAS), score sur le Sinonasal Outcome test (SNOT) 22) et sur les voies aériennes inférieures (questionnaire sur le contrôle de l'asthme (ACQ- 5) et questionnaire sur la qualité de vie dans l'asthme (AQLQ)).
Évaluation du score de polype nasal (NPS)
La taille des polypes nasaux a été évaluée par le NPS, allant de 0 (pas de polype) à 4 (polypes nasaux atteignant le fond de la cavité nasale) de chaque côté en utilisant l'endoscopie nasale, comme rapporté précédemment (23).
Évaluation de la réponse thérapeutique (TRE) et de l'état de la maladie La réponse thérapeutique à un produit biologique a été mesurée à l'aide des 5 critères suivants, conformément aux critères EUFOREA/EPOS (21): 1) réduction du SNP, 2) réduction de la nécessité d'une OCS/chirurgie de sauvetage, 3) amélioration de l'odorat, 4) amélioration de la qualité de vie et 5) réduction de l'impact des comorbidités. Une réponse bonne-excellente a été définie comme répondant à 4 ou 5 critères, une réponse modérée à 2 ou 3 critères et une réponse nulle/mauvaise à 0 ou 1 critère.
Le niveau de contrôle a été mesuré selon les critères EUFOREA/EPOS pour l'évaluation du contrôle chez les patients atteints de CRSwNP au début de l'étude et 3, 12 et 24 semaines après le début de la thérapie biologique. Les patients présentant un score VAS ≤ 5 cm pour la sévérité globale des symptômes sinonasaux ont été définis comme contrôlés. La sévérité globale des symptômes était basée sur les scores VAS individuels pour l'obstruction nasale, la rhinorrhée, l'anosmie, l'écoulement post-nasal, la douleur faciale et les maux de tête (21).
Évaluation des effets indésirables et de l'observance du traitement
Lors de chaque consultation externe, on a demandé aux patients s'ils avaient subi des événements indésirables (EI), si on leur avait prescrit des antibiotiques et/ou des corticostéroïdes oraux ou s'ils avaient subi une révision de l'ESS. En outre, on a vérifié que les patients respectaient le schéma de traitement avec des produits biologiques, des corticostéroïdes nasaux et des irrigations nasales en tant que traitement standard.
Analyse des données
Les analyses statistiques ont été réalisées avec GraphPad Prism VI pour Macintosh Version 8.4.3 (GraphPad Software Inc., San Diego, CA, USA). Les différences entre les caractéristiques de base des deux produits biologiques ont été calculées à l'aide du test exact de Fisher pour les variables catégorielles et du test t non apparié pour les variables continues. Les différences entre le score des polypes nasaux et les différents PRO à différents moments ont été calculées à l'aide d'une analyse d'effets mixtes avec le test de comparaisons multiples de Tukey. Les différences entre les scores VAS à 24 semaines et au début de l'étude ont été calculées à l'aide d'un test T apparié ou d'un test de rang signé de Wilcoxon en fonction de la normalité. Les valeurs seront considérées comme statistiquement significatives si p < 0,05.
Résultats
Caractéristiques de base
167 patients atteints de CRSwNP ont été inclus au départ, dont 144 (86 %) ont été traités par mépolizumab et 23 (14 %) par omalizumab, en plus des rinçages nasaux et de la corticothérapie nasale (figure 1). L'âge moyen était de 53 ans dans les deux groupes. Notre cohorte comptait près de 10 % d'hommes de plus que de femmes, la durée moyenne de la maladie était supérieure à 10 ans, et la majorité des patients avaient déjà subi un ou deux ESS dans le passé. Tous les patients sous omalizumab souffraient d'asthme comorbide, contre 75 % des patients sous mépolizumab. Cette différence peut être attribuée aux critères de remboursement de l'omalizumab en Belgique en 2022 et 2023, l'asthme comorbide étant un critère, qui a changé en novembre 2023. Les patients du groupe mépolizumab présentaient un taux d'éosinophiles sanguins significativement plus élevé que ceux du groupe omalizumab. D'autres paramètres sont énumérés dans le tableau 1.
Évaluation des principaux paramètres cliniques
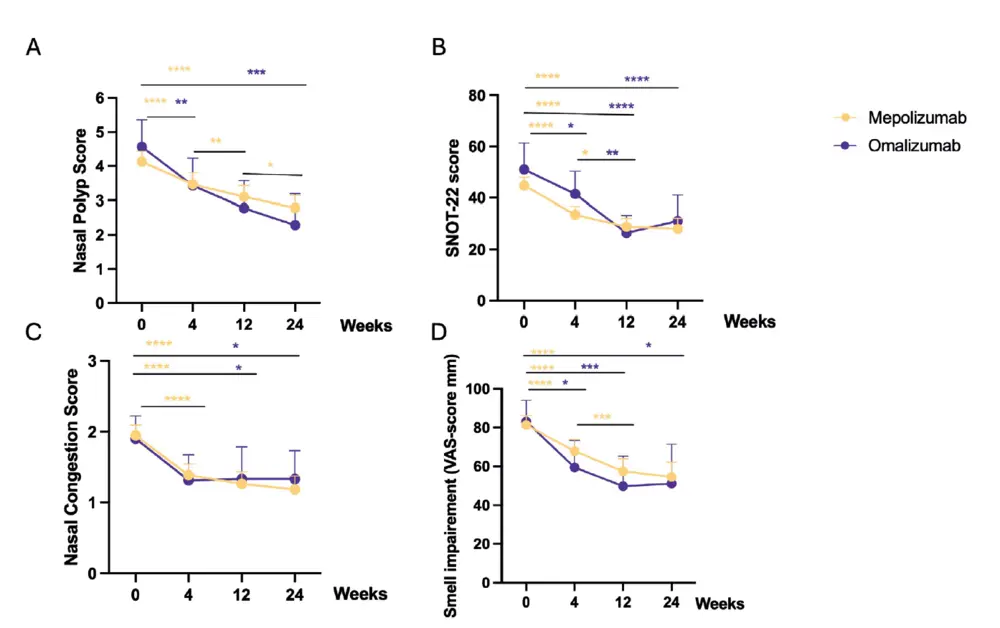
Une différence significative a été observée entre les valeurs initiales et les 24 semaines de traitement pour les deux produits biologiques sur tous les principaux paramètres cliniques : NPS, SNOT-22, perte d'odorat et NCS. Le NPS moyen au départ était de 4,1 (IC 4,4-3,8) pour le mépolizumab
et de 4,5 (IC 5,4-3,8) pour l'omalizumab et a chuté avec une différence moyenne de 1,3 (IC -1,7 à -0,97) et de 2,2 (IC -3,6 à -1,0) points, respectivement (figure 2A). Le score SNOT-22 moyen au départ était de 44,8 (IC 48,0-41,5) et 51,0 (IC 61,4-40,7) et a chuté avec une différence moyenne de -17,2 (IC -21,1 à -13,3) et -18,9 (IC -28,6 à -9,2) pour le mépolizumab et l'omalizumab, respectivement (Figure 2B). Le score de congestion nasale est passé de 2 (IQR 3-1) à l'inclusion à 1 (IQR 2-0) à 4 semaines, et est resté stable autour de ce niveau tout au long de l'essai, ne représentant que des symptômes légers (Figure 2C). En outre, on a observé une réduction significative des scores EVA pour l'anosmie entre l'inclusion et 24 semaines, avec une réduction moyenne de -27 (IC -36 à -18) mm pour le mépolizumab et de -32 (IC -57 à -7) mm pour l'omalizumab. Cependant, le score VAS moyen pour l'anosmie à 24 semaines est resté élevé, à 55 (IC 62-47) pour le mépolizumab et 51 (IC 71-31) pour l'omalizumab (Figure 2D). Entre 12 et 24 semaines, le NPS a encore diminué de manière significative dans le groupe mépolizumab, mais pas dans le groupe omalizumab. Cette diminution n'a pas été observée pour le SNOT-22, le NCS et les scores d'altération de l'odorat (figure 2A-D).
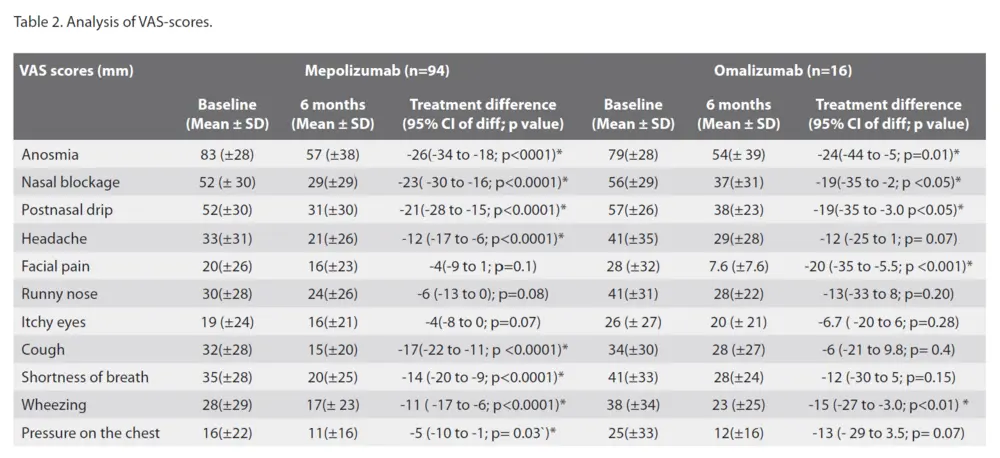
Si l'on examine les scores VAS pour les différents symptômes sinonasaux, la réduction la plus importante des scores VAS a été observée pour les troubles de l'odorat, comme indiqué plus haut. Les autres symptômes importants étaient l'obstruction nasale et l'écoulement postnasal. Les scores EVA pour l'obstruction nasale ont diminué en moyenne de -23 (IC -30 à -16) mm pour le mépolizumab et de -19 (IC -35 à -2) mm pour l'omalizumab. Pour l'écoulement post-nasal, les scores EVA ont diminué en moyenne de -21 (IC -28 à -15) mm pour le mépolizumab et de -19 (IC -35 à -3,0) mm pour l'omalizumab. D'autres symptômes, tels que les céphalées et les douleurs faciales, étaient déjà évalués assez faiblement au départ, le score EVA pour les céphalées ne s'améliorant significativement que dans le cas du mépolizumab, avec -12 (IC -17 à -6) mm, et le score EVA pour les douleurs faciales dans le cas de l'omalizumab, avec -20 (IC -35 à -5,5) mm (tableau 2).
Évaluation des symptômes des voies respiratoires inférieures
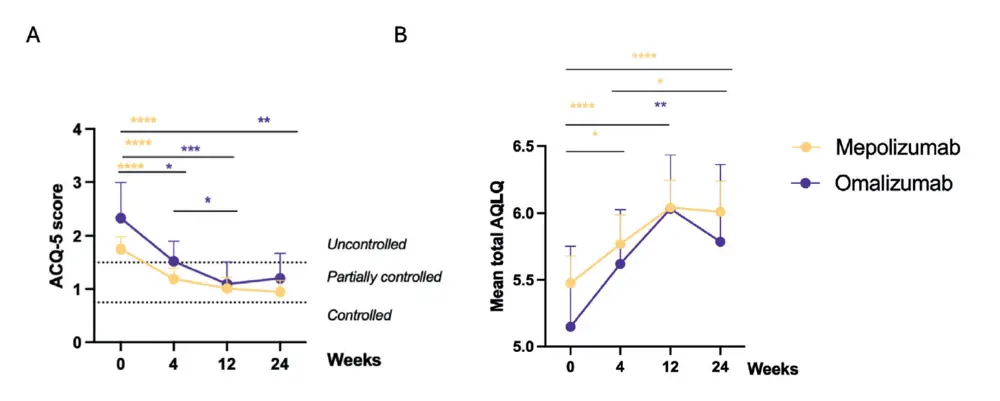
Cette étude a également évalué les effets des produits biologiques sur les symptômes des voies respiratoires inférieures chez les patients atteints de CRSwNP, étant donné que 80 % de notre cohorte de patients souffraient d'asthme comorbide.
patients souffraient d'asthme comorbide. Un effet significatif a été observé sur le contrôle de l'asthme rapporté par les patients, mesuré par le score ACQ-5 (figure 3A). La plupart de nos patients souffraient d'un asthme non contrôlé au départ, avec un score ACQ-5 moyen de 1,8 (IC 2,0-1,5) dans le groupe mépolizumab et de 2,3 (IC 3,0-1,7) dans le groupe omalizumab. Sous biothérapie, le score ACQ-5 s'est généralement amélioré pour un asthme partiellement contrôlé à 24 semaines, avec une amélioration moyenne de -0,8 (IC -1,1 à -0,5) pour le mépolizumab et de -1,1 (IC 2,0 à -0,3) pour l'omalizumab. (En ce qui concerne la qualité de vie, mesurée par le score AQLQ, une amélioration significative a été observée pour le mépolizumab à 24 semaines, avec une amélioration moyenne de 0,5 (IC 0,3 à 0,8) (Figure 3B). Une amélioration significative a été observée pour les deux produits biologiques sur le score VAS des sifflements, avec une réduction moyenne de -11 (IC -17 à -6) mm pour le mépolizumab et de -15 (IC -27 à-3) mm pour l'omalizumab (tableau 2).
Évaluation de la réponse thérapeutique (TRE) et état de la maladie à 24 semaines
À 24 semaines, la prolongation du traitement est décidée en fonction de l'évaluation de la réponse thérapeutique, d'une part, et des critères nationaux de remboursement, d'autre part. Le traitement a été poursuivi au-delà de 24 semaines chez 81 % des patients sous mépolizumab et 74 % des patients sous omalizumab (figure 4A). 45% des patients sous mépolizumab et 47% des patients sous omalizumab ont eu une excellente ERT selon les critères EUFOREA/EPOS avec seulement 14% des patients sous mépolizumab et 12% des patients sous omalizumab n'ayant pas ou peu de réponse à un produit biologique (Figure 4B). Bien que près de 50 % des patients aient eu une excellente réponse à leur produit biologique à 24 semaines, le contrôle n'a été atteint que chez 34 % des patients sous mépolizumab et 35 % des patients sous omalizumab (Figure 4D). Parmi les patients ayant obtenu une excellente TRE, 65 % sous mépolizumab et 75 % sous omalizumab répondaient aux critères de contrôle (Figure 4C). Dans la cohorte de patients ayant poursuivi leur traitement biologique, le contrôle a été atteint chez 41 % et 46 % des patients sous mépolizumab et omalizumab, respectivement. Enfin, dans le groupe qui a arrêté son traitement biologique, la raison principale était l'absence de réponse, seuls trois patients ont arrêté en raison d'effets secondaires (zona et/ou douleurs musculo-squelettiques) et un patient a été arrêté par le médecin en raison d'un manque d'observance (Figure 1). 50 % des patients qui ont arrêté l'omalizumab et 36 % des patients qui ont pris du mépolizumab sont passés à un autre produit biologique.
Adhésion au traitement et sécurité
Aucun événement indésirable grave n'a été signalé pendant l'instauration et le déroulement du traitement biologique. La plupart des patients se sont auto-administrés leurs injections à domicile après deux ou trois injections en clinique sous surveillance médicale. L'adhésion au traitement déclarée par les patients était bonne, seuls 5 % d'entre eux ayant déclaré avoir manqué une injection, principalement en raison de facteurs externes tels que la disponibilité limitée du produit biologique à la pharmacie ou l'expiration de la couverture de remboursement avant que toutes les seringues n'aient pu être obtenues. Comme mentionné précédemment, seuls trois patients ont arrêté leur traitement prématurément en raison d'effets secondaires (Figure 1).
Discussion
Ce registre dans huit centres de rhinologie en Belgique inclut 167 patients atteints de CRSwNP sévère et rapporte l'ERO de l'omalizumab et du mépolizumab chez des patients atteints de CRSwNP répondant aux critères de remboursement nationaux. Cette étude confirme l'efficacité des deux produits biologiques, telle que rapportée dans l'étude DBRCT, avec une amélioration significative de tous les paramètres primaires à 12 et 24 semaines de traitement. Le contrôle de la maladie a été atteint chez un tiers des patients des deux groupes à 24 semaines.
La comparaison de ces données belges en situation réelle avec les essais DBRCT rapportés (7,9,10,12) permet de faire plusieurs observations.
Tout d'abord, le score SNOT-22 de départ et l'amélioration moyenne observée dans notre étude (-17,2 à -18,9) étaient comparables à la réduction moyenne rapportée dans les deux essais DBRCT de l'omalizumab et du mépolizumab (-9,40 à -16,2), ce qui indique une efficacité comparable dans la réduction de la charge de morbidité (12). La réduction du SNC dans cet essai à 24 semaines était similaire à celle rapportée dans les essais de phase III sur l'omalizumab (7), tout comme les scores VAS pour la perte d'odorat, les réductions observées ici étant similaires à celles des essais de phase III sur le mépolizumab (9). Il est intéressant de noter que le NPS de base dans la cohorte actuelle était plus faible (4,1-4,5) que dans les DBRCT, où un TNPS de 5 ou plus était un critère d'inclusion pour la randomisation. Malgré le NPS de base plus faible dans ce registre, la différence moyenne standard à 24 semaines dans le NPS rapportée ici était plus importante 1,3 (CI -1,7 à -0,97) et 2,2 (CI -3,6 à -1,0), par rapport aux DBRCTs -0,85 (CI -1,06 à -0,64). Cette observation pourrait s'expliquer par l'inclusion de patients moins sévères dans notre RWE que dans le RDBCT, ou par la notation en aveugle du NPS dans le RWE par rapport au RDBCT. Haxel et al (17) ont également fait état d'une tendance similaire à des améliorations cliniques plus prononcées dans leurs données de l'EFR par rapport aux changements moyens dans les données de la phase III. Ils ont suggéré une meilleure sélection des maladies inflammatoires de type II dans la vie réelle, où les comorbidités associées au type II, telles que l'asthme, sont plus fréquentes que dans les RDBCT. En effet, dans notre cohorte, 80 % des patients souffrent d'asthme comorbide, ce qui est conforme à d'autres études sur l'EFR (15,17,24,25), mais nettement plus élevé que les 60 à 70 % rapportés dans les essais de phase III (7,9).
Il est intéressant de noter que les effets majeurs de la thérapie biologique ont été observés après 12 semaines de traitement sans amélioration supplémentaire significative
des PRO tels que le NCS, le score SNOT-22, l'AQLQ ou le score ACQ5 entre 12 et 24 semaines. Il convient de noter que le NPS a diminué entre 12 et 24 semaines de traitement dans le groupe mépolizumab uniquement, sans impact sur les paramètres subjectifs. Cette observation mérite d'être replacée dans son contexte. Tout d'abord, le SNP n'est pas directement corrélé aux paramètres de résultats pertinents pour le patient, tels que la perte d'odeur, la congestion ou les scores SNOT (26). Deuxièmement, l'absence de bénéfice supplémentaire de l'omalizumab après 12 semaines n'exclut pas un bénéfice supplémentaire au-delà de 24 semaines de traitement et pourrait être une conséquence de la taille limitée de l'échantillon par rapport au groupe mépolizumab. Une étude de comparaison indirecte réalisée par le passé (10) avait déjà laissé entrevoir un possible effet plateau après 14 semaines de traitement, les différences observées entre 16 et 24 semaines de traitement étant limitées dans les essais cliniques.
24 semaines de traitement dans les essais cliniques avec l'omalizumab et le mépolizumab. Ce phénomène a été confirmé par plusieurs autres études d'EFR portant sur le dupilumab et/ou l'omalizumab (16,17). Nous confirmons maintenant ce résultat chez les patients traités par omalizumab et mépolizumab. Nous ne pouvons que spéculer sur une diminution supplémentaire des NPS et/ou des paramètres pertinents pour les patients au-delà de 24 semaines de traitement. Cependant, l'étude de Cavaliere et al. a montré une amélioration significative entre 24 et 52 semaines du SNP, du SNOT-22 et des scores VAS de perte d'odorat chez les patients traités par le mépolizumab.
En comparant nos données d'ERT avec d'autres études d'ERT de produits biologiques, nous pouvons principalement établir des comparaisons avec des registres de dupilumab tels que le registre italien de De Corso et al (14), la cohorte néerlandaise de Van der Lans et al (15) et l'étude allemande de Haxel et al (17), qui était la seule à analyser l'ERT sur une population comprenant à la fois des patients traités par dupilumab et par omalizumab (14,15,17).
Il est frappant de constater que plus de patients dans la cohorte italienne (57,7 %) et la cohorte allemande (56 %) ont atteint une excellente réponse thérapeutique par rapport à notre cohorte (45-47 %) et à l'étude de Van der Lans et al. (40,7 %). De plus, un pourcentage plus élevé de non-répondeurs a été observé dans notre cohorte de patients (12-14%) par rapport à la cohorte de De Corso et al. (1,2-1,9%), Van der Lans et al. (3,7%) et Haxel et al. (1%) (14,15,17). Cependant, il est possible qu'un traitement ou un suivi plus long puisse révéler un pourcentage plus élevé de patients présentant une réponse thérapeutique bonne ou excellente que ce qui est actuellement rapporté à 24 semaines. Il convient d'être prudent lors de l'interprétation des résultats de différents registres, car les critères historiques pour définir une réponse thérapeutique diffèrent légèrement d'un registre à l'autre, et les critères de remboursement diffèrent d'un pays à l'autre (1,14,15,17).
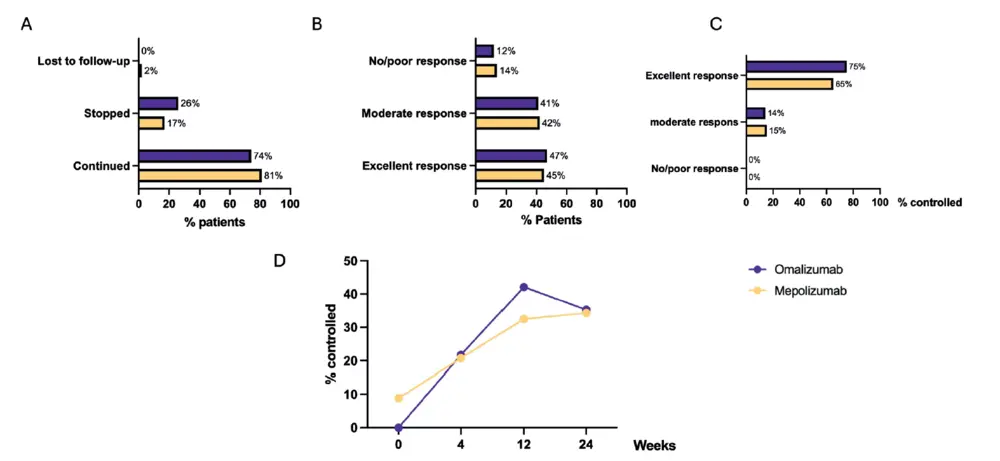
Comme nous l'avons déjà mentionné, le présent rapport a pour but d'inclure la nouvelle définition du contrôle dans le contexte réel d'un registre belge (21).
registre belge (21). Il est frappant de constater que, bien que près de 50 % des patients traités par omalizumab ou mépolizumab aient présenté une excellente réponse à leur traitement biologique selon les critères EUFOREA/EPOS (21), seul un tiers d'entre eux ont obtenu un contrôle de la maladie. Cette divergence peut être largement attribuée au fait que le score VAS moyen d'anosmie à 24 semaines est resté assez élevé, autour de 54 sur 100, malgré une réduction significative du score VAS de perte d'odorat. Cela a empêché de nombreux patients d'atteindre un état de contrôle de la maladie, défini par l'absence de symptômes gênants avec un score EVA < 50 mm. Plusieurs facteurs doivent être pris en compte lors de l'interprétation de ces données : la plupart des patients présentaient initialement un score EVA élevé (c'est-à-dire 8/10). Bien que les scores VAS de l'anosmie soient restés élevés à 24 semaines, les deux groupes de traitement ont montré une réduction moyenne significative de 2 points.
les deux groupes de traitement ont montré une réduction moyenne significative de 2 points. En outre, la plupart de nos patients avaient subi une ou deux opérations des sinus dans le passé, ce qui peut avoir contribué à la perte persistante de l'odorat. Ce facteur aurait pu influencer les scores de l'EVA de l'anosmie. C'est pourquoi l'efficacité des produits biologiques est analysée non seulement en fonction de l'odorat, mais aussi de plusieurs autres paramètres de résultats cliniques, tels que les effets sur le SNOT-22 et le NPS. Nous reconnaissons qu'un test d'odorat semi-objectif aurait fourni des informations supplémentaires sur l'étendue de l'anosmie. Cependant, comme cela ne fait pas partie de la norme de soins dans la plupart des hôpitaux, cela n'a pas été incorporé dans cet essai d'observation.
Au fur et à mesure que des données à long terme seront disponibles, il sera intéressant d'observer comment le niveau de contrôle évolue chez ces patients et si certains d'entre eux sont sur la voie de la rémission. Dans notre registre, nous ne semblons pas observer de différences en termes d'efficacité ou de contrôle entre le mépolizumab et l'omalizumab à 12 et 24 semaines. Cependant, ceci pourrait être influencé par la plus petite cohorte de patients sous omalizumab (23 patients) comparée à la cohorte de mépolizumab (144 patients), reflétant les critères de remboursement plus stricts pour l'omalizumab au cours de la première année de remboursement en Belgique, ce qui semble être un déterminant important dans le choix d'un produit biologique dans notre cohorte belge. De plus, l'absence de calcul de dose ou de schéma d'injection multiple avec le mépolizumab peut avoir contribué à sa facilité de prescription perçue.
Enfin, l'adhésion des patients à leur traitement biologique a été particulièrement élevée, 95 % des patients n'ayant pas oublié une seule injection, et les taux d'abandon n'ont été que de 2 %. Les injections manquées étaient principalement dues à des facteurs externes tels que la disponibilité limitée du produit biologique à la pharmacie ou l'expiration de la couverture de remboursement avant que toutes les seringues aient pu être obtenues. Ce taux d'adhésion élevé est probablement attribuable aux améliorations cliniques relativement rapides et significatives observées chez les patients recevant des produits biologiques, contrairement à d'autres traitements tels que les rinçages nasaux et/ou les corticostéroïdes intranasaux, et peut également contribuer au coût élevé de la thérapie. Conformément aux conclusions d'autres essais cliniques et études d'EFR, le profil d'innocuité était bon, seuls des effets secondaires mineurs ayant été signalés. Plus précisément, seuls trois patients sur les 167 ont interrompu le traitement en raison d'effets indésirables potentiels liés à la biologie, tels que le zona ou des douleurs musculo-squelettiques (13,27).
Conclusion
Six mois de traitement par mépolizumab ou omalizumab ont significativement amélioré les résultats rapportés par les patients,
avec des effets majeurs observés à 12 semaines et une réduction supplémentaire des NPS entre 12 et 24 semaines dans le groupe traité par mépolizumab.
dans le groupe traité par mépolizumab. Près de la moitié des patients inclus ont montré une excellente réponse thérapeutique à leur traitement biologique, un tiers d'entre eux ayant atteint le contrôle à la semaine 24. Un suivi supplémentaire au-delà de six mois est justifié pour évaluer les effets supplémentaires d'une part et l'évolution vers la rémission d'autre part.
Remerciements
Nous tenons à remercier tous les investigateurs principaux et les sous-investigateurs de l'essai RELIBIO pour leurs efforts.
Contribution des auteurs
PH : conceptualisation, méthodologie, révision et édition, supervision ; ASV : collecte de données, analyse formelle, rédaction, préparation du projet original, révision et édition ; LB : collecte de données, analyse formelle ; EB : collecte de données, révision et édition ; SH, VH, MJ, WL, FR, KS, LVG, OV, BV, AV : collecte de données, révision et édition ; KM : révision et édition ; Tous les auteurs ont lu et approuvé la version publiée du manuscrit.
Conflit d'intérêts
Tous les auteurs déclarent que la recherche a été menée en l'absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d'intérêts potentiel.
Financement
Ce projet n'a bénéficié d'aucun financement/soutien spécifique.
Références
1. Fokkens W, Viskens AS, Backer V, et al. EPOS/EUFOREA update on indication and evaluation of Biologics in Chronic Rhinosinusitis with Nasal Polyps 2023. Rhinologie. 2023. 61(3):194-202.
2. Fokkens WJ, Lund VJ, Hopkins C, et al. European Position Paper on Rhinosinusitis and Nasal Polyps 2020. Rhinology. 2020;58(Suppl S29):1-464.
3. Orlandi RR, Kingdom TT, Smith TL, et al. Déclaration de consensus international sur l'allergie et la rhinologie : rhinosinusite 2021. Int Forum Allergy Rhinol. 2021;11(3):213-739.
4. Hellings PW, Fokkens WJ, Orlandi R, et al. The EUFOREA pocket guide for chronic rhinosinusitis. Rhinology. 2023;61(1):85-89.
5. Commission européenne. Registre des médicaments de l'Union [Internet]. Disponible à l'adresse : https://ec.europa.eu/health/documents/community-register/html/.
6. U.S. Food & drug administration. FDAApproved Drugs [Internet]. Disponible à l'adresse : https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm.
7. Gevaert P, Omachi TA, Corren J, et al. Efficacité et sécurité de l'omalizumab dans la polypose nasale : 2 essais randomisés de phase 3. J Allergy Clin Immunol. 2020;146(3):595-605.
8. Bachert C, Han JK, Desrosiers M, et al. Efficacité et sécurité du dupilumab chez les patients atteints de rhinosinusite chronique sévère avec polypes nasaux (LIBERTY NP SINUS-24 et LIBERTY NP SINUS-52) : résultats de deux essais de phase 3 multicentriques, randomisés, en double aveugle, contrôlés par placebo et en groupes parallèles. Lancet. 2019;394(10209):1638-1650.
9. Han JK, Bachert C, Fokkens W, et al. Mepolizumab for chronic rhinosinusitis with nasal polyps (SYNAPSE) : a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Resp Med. 2021;9(10):1141-1153.
10. Hellings PW, Verhoeven E, Fokkens WJ. Aperçu de l'état de l'art sur le traitement biologique pour le CRSwNP. Rhinology. 2021;59(2):151-163.
11. Peters AT, Han JK, Hellings P, et al. Indirect treatment comparison of biologics in chronic rhinosinusitis with nasal polyps. J Allergy Clin Immunol Pract. 2021;9(6):2461-2471.
12. Cai S, Xu S, Lou H, Zhang L. Comparison of different biologics for treating chronic rhinosinusitis with nasal polyps : a network analysis. J Allergy Clin Immunol Pract. 2022;10(7):1876-1886.
13. Oykhman P, Paramo FA, Bousquet J, Kennedy DW, Brignardello-Petersen R, Chu DK. Comparative efficacy and safety of monoclonal antibodies and aspirin desensitization for chronic rhinosinusitis with nasal polyposis : A systematic review and network meta-analysis. J Allergy Clin Immunol. 2022;149(4):1286-1295.
14. De Corso E, Pasquini E, Trimarchi M, et al. Dupilumab in the treatment of severe uncontrolled chronic rhinosinusitis with nasal polyps (CRSwNP) : a multicentric observational Phase IV real-life study (DUPIREAL). Allergie. 2023;78(10):2669-2283.
15. Lans RJL vd, Fokkens WJ, Adriaensen GFJPM, Hoven DR, Drubbel JJ, Reitsma S. Real-life
observational cohort verifies high efficacy of dupilumab for chronic rhinosinusitis with nasal polyps. Allergy. 2022;77(2):670-674.
16. Kilty SJ, Lasso A. Canadian real-world study of access and clinical outcomes using dupilumab for chronic rhinosinusitis with polyps. J Otolaryngol Head Neck Surg. 2022;51(1):17.
17. Haxel BR, Hummel T, Fruth K, et al. Realworld-effectiveness of biological treatment for severe chronic rhinosinusitis with nasal polyps. Rhinology. 2022;60(6):435-443.
18. Domínguez-Sosa MS, Cabrera-Ramírez MS, Marrero-Ramos MDC, et al. Real-life effectiveness of mepolizumab in refractory chronic rhinosinusitis with nasal polyps. Biomedicines. 2023;11(2):485.
19. Lombardo N, Piazzetta GL, Lobello N, et al. Real-life effects of omalizumab on chronic rhinosinusitis with nasal polyposis. J Pers Med. 2023;14(1) : 3.
20. Centre belge d'information pharmacothérapeutique. Commented drug repertory [Internet]. Disponible à l'adresse : https://www.bcfi.be/nl/
21. Fokkens WJ, De Corso E, Backer V, et al. EPOS2020/EUFOREA expert opinion on defining disease states and therapeutic goals in CRSwNP. Rhinology. 2024;62(3):287-298.
22. Xu X, Reitsma S, Wang Y, Fokkens WJ. Updates in biologic therapy for chronic rhinosinusitis with nasal polyps and NSAIDexacerbated respiratory disease. Allergy. 2022. 77(12):3593-3605.
23. Gevaert P, De Craemer J, Bachert C, et al. European Academy of Allergy and Clinical Immunology position paper on endoscopic scoring of nasal polyposis. Allergy. 2023;78(4):912-922.
24. Cavaliere C, Loperfido A, Ciofalo A, et al. Real-life evidence of mepolizumab treatment in chronic rhinosinusitis with nasal polyps : a multicentric study. J Clin Med. 2024;13(12) : 3575.
25. Kiricsi A, Bella Z, Kraxner H, et al. Real-life effectiveness of dupilumab in chronic rhinosinusitis with nasal polyps. Résultats de huit centres hongrois avec un suivi de 12 mois. Rhinology. 2024;62(4):410-420.
26. Jeong S, Chen T, Nguyen S, Edwards T, Schlosser R. Correlation of polyp grading scales with patient symptom scores and olfaction in chronic rhinosinusitis : a systematic review and meta-analysis. Rhinology. 2022;60;5 : 322-334.
27. Dorling M, Hernaiz-Leonardo JC, Pascual A, Janjua A, Thamboo A, Javer A. Real-world adverse events after type 2 biologic use in chronic rhinosinusitis with nasal polyps. Laryngoscope. 2024;134(7):3054-3059.
Peter W. Hellings
Herestraat 49
3000 Leuven
Belgique
Tél : +32486948703
E-mail : peter.hellings@kuleuven.be
An-Sofie Viskens1,2, Laura Bollens3, Elien Borgers4, Stijn Halewyck5, Valérie Hox6, Mark Jorissen4,7, Winde Lemmens8, Florence Rogister9, Kato Speleman10, Laura Van Gerven1,4,7, Olivier Vanderveken2,11, Benedicte Verhaeghe12, Anneclaire Vroegop2,11, Katleen Martens1, Peter W. Hellings1,4,13
1 Département de microbiologie, d'immunologie et de transplantation de la KU Leuven, Unité de recherche sur l'allergie et l'immunologie clinique, Leuven, Belgique
2 Faculté de médecine et des sciences de la santé, Université d'Anvers, Anvers, Belgique
3 Faculté de médecine, KU Leuven, Leuven, Belgique
4 Département d'oto-rhino-laryngologie et de chirurgie de la tête et du cou, UZ Leuven, Leuven, Belgique
5 Département d'oto-rhino-laryngologie, Hôpital universitaire de Bruxelles, Jette, Belgique
6 Service d'oto-rhino-laryngologie, Hôpital universitaire Saint-Luc, Bruxelles, Belgique
7 Laboratoire d'oto-rhino-laryngologie expérimentale, Département des neurosciences, KU Leuven, Leuven, Belgique
8 Département d'oto-rhino-laryngologie, hôpital Oost-Limburg, Genk, Belgique
9 Département d'oto-rhino-laryngologie, CHU de Liège, Belgique
10 Service d'oto-rhino-laryngologie, Hôpital général Sint-Jan Bruges, Bruges, Belgique
11 Département de chirurgie oto-rhino-laryngologique, tête et cou, Hôpital universitaire d'Anvers, Edegem, Belgique
12 Département d'oto-rhino-laryngologie, hôpital Onze Lieve Vrouw, Aalst, Belgique
13 Laboratoire de recherche sur les voies aériennes supérieures, Université de Gand, Gand, Belgique
Rhinologie 63 : 3, 316 - 324, 2025 https://doi.org/10.4193/Rhin24.463
Reçu pour publication : 30 octobre 2024
Accepté : 8 mars 2025
Rédacteur en chef adjoint : Sietze Reitsma

