Cardiopathies
Amylose cardiaque: une thérapie génique à l’essai
 L’Hôpital Citadelle (Liège) est l’un des cinq centres belges qui participent à l’étude Magnitude, un essai clinique basé sur une technologie d’édition génomique (CRISPR-Cas9, déjà récompensée par le prix Nobel) qui cible l’amylose à transthyrétine dite « ATTR ». Un potentiel « game changer » dans la prise en charge de cette pathologie finalement moins rare qu’on ne le pensait.
L’Hôpital Citadelle (Liège) est l’un des cinq centres belges qui participent à l’étude Magnitude, un essai clinique basé sur une technologie d’édition génomique (CRISPR-Cas9, déjà récompensée par le prix Nobel) qui cible l’amylose à transthyrétine dite « ATTR ». Un potentiel « game changer » dans la prise en charge de cette pathologie finalement moins rare qu’on ne le pensait.
Cinq centres cliniques belges
Cette étude pivot de phase 3 est une étude internationale randomisée à laquelle participent cinq centres de recherche clinique belges : l’UZ Anvers, l’UZ Leuven, l’AZ Sint-Jan à Bruges et, côté francophone, l’Hôpital Érasme (HUB) et l’Hôpital Citadelle de Liège, seul centre francophone non universitaire sélectionné pour cet essai clinique à la fois novateur et prometteur.
Basée sur la thérapie génique expérimentale CRISPR-Cas9, l’étude Magnitude s’adresse aux patients atteints d’une forme précise d’amylose: l’amylose à transthyrétine avec cardiomyopathie associée (ATTR-CM).
« La transthyrétine (TTR) est une protéine tétramérique composée de quatre sous-unités produite dans le foie. Chez les patients atteints d’une amylose cardiaque, le tétramère est instable, il entraîne des monomères qui vont s'agréger sous forme de fibrilles amyloïdes qui vont s’accumuler et se déposer dans différents organes dont le cœur», contextualise d’emblée le Dr Pierre Troisfontaines, chef du service de cardiologie du CHR de la Citadelle qui participe à cet essai clinique.
Amylose ATTR: une forme héréditaire et une forme «sauvage»
Il existe deux sous-types d’amylose ATTR: l’amylose ATTR héréditaire (hATTR) ou mutée (ATTRv), elle est due à une mutation génétique du gène codant la TTR, transmise de manière autosomique dominante. La forme sauvage (non mutée) de l’amylose ATTR (ATTRwt) : elle serait due au vieillissement naturel de la TTR.
Dans la forme héréditaire, plus de 120 mutations ont été identifiées jusqu’ici. Des familles entières sont suivies à l’Hôpital Citadelle, notamment originaires de régions d’Europe où la maladie est endémique et la prévalence plus grande (Portugal, Espagne, Italie). « Tous n’ont pas une cardiomyopathie, il y a des formes prépondérantes avec manifestations neurologiques. Il existe aussi des phénotypes mixtes avec des présentations neurologiques et cardiologiques », détaille le Dr Troisfontaines. « Certains patients ont des troubles conductifs avec un BAV qui nécessite la pose d’un pacemaker… avant que l’on ne leur découvre en réalité une amylose. D’autres souffrent de polyneuropathies pendant des années avant que l’on ne s’intéresse à leur cœur. » D’où l’intérêt d’une approche pluridisciplinaire.
Dans la forme dite "sauvage" (ou "sénile" ou "non mutée"), le tétramère se déstabilise avec le temps et entraîne des dépôts d’amylose. Ce sont souvent des patients de plus de 65 ans. L'analyse génétique permet de différencier les deux formes. Une biopsie myocardique peut être réalisée chez les patients qui présentent les deux types.
Une pathologie systémique
« C’est une maladie systémique, avec un éventail de manifestations qui ne touchent pas que le cœur : elle peut aussi engendrer des atteintes neurologiques (syndromes du canal carpien, troubles oculaires), des problèmes digestifs (de transit et des malabsorptions), une insuffisance rénale ou encore des troubles du système nerveux autonome (hypotension orthostatique, sudation profuse, dysfonction érectile...). »
Pas étonnant, vu ce tableau symptomatologique vaste, que nombre de patients soient confrontés à une errance diagnostique qui peut durer plusieurs années.
Grâce à une approche pluridisciplinaire (impliquant cardiologues, neurologues, gériatres…) et plus systématique (lire l'étude rétrospective menée à Liège), la Belgique peut se targuer d’être aujourd’hui un modèle dans le dépistage de cette pathologie que l’on classait naguère parmi les maladies rares: il semble désormais qu’elle soit plus fréquente que ce que l’on imaginait, notamment dans sa forme sauvage (ATTRwt).
On estime que 50.000 personnes, à travers le monde, vivent avec l'amyloïdose ATTRv, et entre 200.000 et 500.000 avec l'amyloïdose ATTRwt.
Un « bistouri » génétique
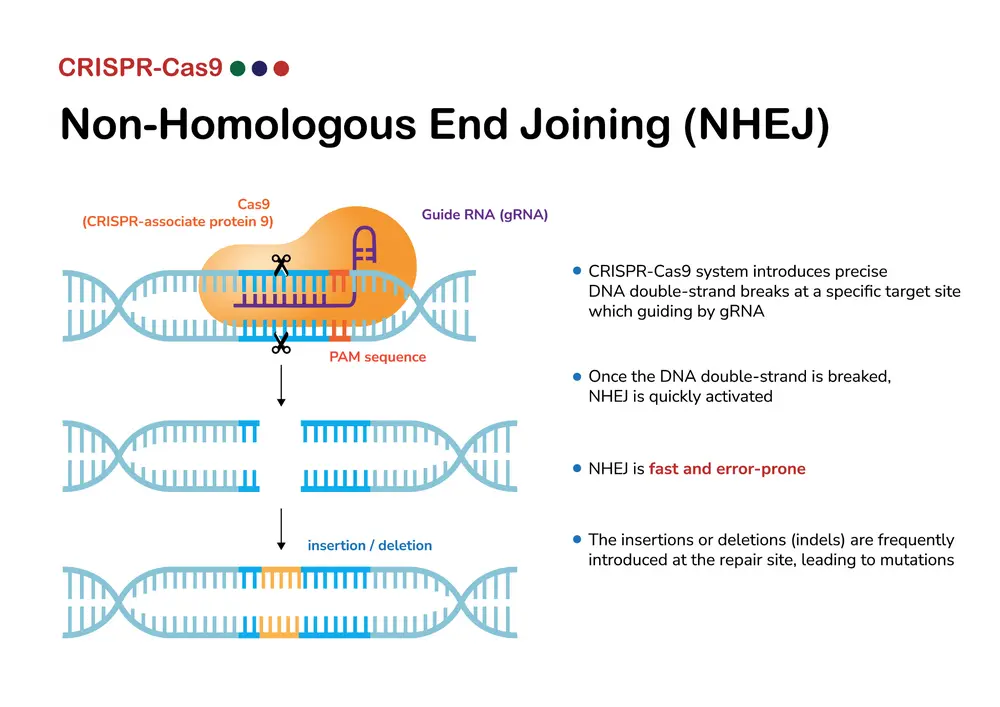 CRISPR-Cas9 n’est pas une molécule classique: c’est un outil d’édition génomique capable de modifier l’ADN là où il pose souci. Cas9, une enzyme, intervient tel un 'scalpel' moléculaire ultra précis, guidé par un ARN guide, pour 'couper' la séquence cible, permettant d’introduire des modifications, comme remplacer ou (in)activer un gène.
CRISPR-Cas9 n’est pas une molécule classique: c’est un outil d’édition génomique capable de modifier l’ADN là où il pose souci. Cas9, une enzyme, intervient tel un 'scalpel' moléculaire ultra précis, guidé par un ARN guide, pour 'couper' la séquence cible, permettant d’introduire des modifications, comme remplacer ou (in)activer un gène.
L’essai Magnitude est tellement prometteur, que le recrutement est passé de 765 patients initialement à 1.200 à travers le monde.
« L’hypothèse de départ est que la mutation va se faire au niveau du site de production de la transthyrétine (foie), avec une réduction possible de la TTR jusqu’à 90 %. »
- Dr Pierre Troisfontaines, chef du service de cardiologie de l'Hôpital Citadelle
Le Dr Troisfontaines table, pour son centre à Liège, sur une dizaine de candidats, les critères d’inclusion et d’exclusion (dont les troubles hépatiques) étant particulièrement stricts. « On peut espérer que ce traitement se révélera un ‘game changer’, c’est-à-dire qu’il changera réellement le devenir des patients. Évoquer une guérison est prématuré pour l'instant. »
À ce jour, une douzaine de patients ont été screenés dans le Centre de recherche clinique de cardiologie. « Toutefois, nous pouvons accueillir, en collaboration avec leurs cardiologues, des patients suivis dans d'autres hôpitaux du pays», rappelle le Dr Troisfontaines. « Nous réalisons des études cliniques depuis plus de 20 ans, avec une certaine expertise et reconnaissance. »
Outre l’étude Magnitude, deux autres études devraient débuter prochainement dans le cadre de l’amylose cardiaque.
Il n’est pas si loin le temps où les patients souffrant d’amylose étaient redirigés vers la transplantation hépatique… Depuis 2019, deux molécules innovantes sont arrivées sur le marché belge, qui permettent « si pas une nette amélioration, du moins une stabilisation », observe le Dr Troisfontaines. « Les nouvelles molécules qui vont arriver vont être des molécules d'avenir. »
Jusqu’à 90 % de la TTR réduite
Le nom exact du traitement à l’essai est «NTLA 2001» (ou nexiguran zicluneran / nex-z). NTLA-2001 utilise des nanoparticules lipidiques pour transporter deux éléments dans le foie : un ARN guide ciblant le gène TTR, un ARN messager codant pour l’enzyme Cas9, qui coupe précisément l’ADN du gène TTR (regarder la vidéo explicative). Cela entraîne une inactivation permanente du gène TTR dans les cellules hépatiques, réduisant ainsi la production de la protéine pathogène.
L’unique administration se fait sous perfusion (IV en 4h) en hôpital de jour pour garder le patient sous surveillance. Deux tiers des participants recevront la thérapie génique, un tiers le placebo. Le design de l’étude permet aux patients sous tafamidis de ne pas devoir l’arrêter.
« L’hypothèse de départ est que la mutation va se faire au niveau du site de production de la transthyrétine, c'est-à-dire dans le foie », poursuit le médecin spécialiste, « avec une réduction possible de la TTR jusqu’à 90 %, comme l’a montré l’étude de phase 1 dont les premiers résultats sont parus en 2021 dans le New England Journal of Medicine. »
Dépistage: des outils diagnostiques moins invasifs
Les nouvelles techniques diagnostiques moins invasives, la disponibilité récente de molécules et, surtout, la collaboration renforcée entre les différents cliniciens pour détecter les red flags et rassembler les pièces du puzzle parmi la constellation des manifestations de l’amylose, ont permis d’augmenter drastiquement le dépistage.
« Un patient opéré des canaux carpiens bilatéraux et présentant une hypertrophie cardiaque à l’écho, ça doit allumer tous les voyants ! », souligne le Dr Troisfontaines. Un canal lombaire ou cervical étroit peut aussi signer la maladie (dépôts d’amylose dans la gaine). « Entre 10 et 15% des patients référés pour TAVI ou avec une insuffisance cardiaque à fraction d'éjection préservée (HFpEF) présentent une amylose. »
Un algorithme permet désormais, sur base de l’anamnèse, de la clinique et des red flags de suspecter la pathologie, et de réaliser une scintigraphie osseuse corps entier (avec le score de Perugini) - scintigraphie qui permettra de visualiser les dépôts au niveau du cœur - et une immuno-électrophorèse en parallèle pour exclure une amylose AL. « Une fixation marquée au niveau du cœur marque une probabilité à plus de 90% d’amylose à transthyrétine. »
L’amylose AL ou amylose à chaînes légères est une forme fréquente d’amylose cardiaque, liée à une production excessive d’anticorps anormaux par les globules blancs. Cette amylose AL est une maladie hématologique grave, « d’où l’importance d’inclure les hématologues dans l’équipe pluridisciplinaire », conclut le Dr Troisfontaines.
RESSOURCES
- CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis, N Engl J Med 2021;385:493-502
DOI: 10.1056/NEJMoa2107454
- Epidemiology of transthyretin amyloid cardiomyopathy (ATTR-CM) in France, a study based on the systeme national des donnees de sante (SNDS) the French nationwide claims database, European Heart Journal, Volume 42, Issue Supplement_1, October 2021, ehab724.3131, Doi.org/10.1093/eurheartj/ehab724.3131
- Epidemiology of transthyretin (ATTR) amyloidosis: a systematic literature review, Orphanet Journal of Rare Diseases volume 20, Article number: 29 (2025)
- Redefining the epidemiology of cardiac amyloidosis. A systematic review and meta-analysis of screening studies, Eur J Heart Fail. 2022 Dec;24(12):2342-2351. doi: 10.1002/ejhf.2532.
- What's new in cardiac amyloidosis? Pharmacological treatment, physical activity, and care of patients with transthyretin cardiac amyloidosis, Ther Adv Cardiovasc Dis. 2024 Jan-Dec:18:17539447241295957. doi: 10.1177/17539447241295957.
